Jednou z dôležitých otázok pri štúdiu termodynamických systémov vo fyzike je otázka, či tento systém môže vykonávať nejakú užitočnú prácu. S pojmom práca úzko súvisí pojem vnútorná energia. V tomto článku zvážime, aká je vnútorná energia ideálneho plynu a poskytneme vzorce na jej výpočet.
Ideálny plyn
O plyne, ako o stave agregácie, na ktorý vonkajším vplyvom nepôsobí žiadna elastická sila a v dôsledku toho si neuchováva objem a tvar, pozná každý školák. Pojem ideálneho plynu pre mnohých zostáva nepochopiteľný a nejasný. Poďme si to vysvetliť.
Ideálny plyn je každý plyn, ktorý spĺňa nasledujúce dve dôležité podmienky:
- Častice, ktoré ho tvoria, nemajú veľkosť. Majú síce veľkosť, ale v porovnaní so vzdialenosťami medzi nimi je taká malá, že ju možno ignorovať vo všetkých matematických výpočtoch.
- Častice medzi sebou neinteragujú pomocou van der Waalsových síl alebo sílinej povahy. V skutočnosti je takáto interakcia prítomná vo všetkých skutočných plynoch, ale jej energia je zanedbateľná v porovnaní s priemernou energiou kinetických častíc.
Popísané podmienky spĺňajú takmer všetky reálne plyny, ktorých teploty sú nad 300 K a tlaky nepresahujú jednu atmosféru. Pri príliš vysokých tlakoch a nízkych teplotách pozoruje odchýlku plynov od ideálneho správania. V tomto prípade sa hovorí o skutočných plynoch. Sú opísané van der Waalsovou rovnicou.
Koncept vnútornej energie ideálneho plynu
V súlade s definíciou je vnútorná energia systému súčtom kinetických a potenciálnych energií obsiahnutých v tomto systéme. Ak sa tento koncept aplikuje na ideálny plyn, potom by sa potenciálna zložka mala vyradiť. V skutočnosti, keďže častice ideálneho plynu navzájom neinteragujú, možno ich považovať za voľne sa pohybujúce v absolútnom vákuu. Na extrahovanie jednej častice zo skúmaného systému nie je potrebné pracovať proti vnútorným silám interakcie, pretože tieto sily neexistujú.
Vnútorná energia ideálneho plynu sa teda vždy zhoduje s jeho kinetickou energiou. Ten je zase jednoznačne určený molárnou hmotnosťou častíc systému, ich počtom, ako aj priemernou rýchlosťou translačného a rotačného pohybu. Rýchlosť pohybu závisí od teploty. Zvýšenie teploty vedie k zvýšeniu vnútornej energie a naopak.
Vzorec prevnútorná energia
Označte vnútornú energiu ideálneho plynového systému písmenom U. Podľa termodynamiky je definovaná ako rozdiel medzi entalpiou H systému a súčinom tlaku a objemu, teda:
U=H - pV.
V odseku vyššie sme zistili, že hodnota U zodpovedá celkovej kinetickej energii Ek všetkých častíc plynu:
U=Ek.
Zo štatistickej mechaniky v rámci molekulárnej kinetickej teórie (MKT) ideálneho plynu vyplýva, že priemerná kinetická energia jednej častice Ek1 sa rovná nasledujúca hodnota:
Ek1=z/2kBT.
Tu kB a T - Boltzmannova konštanta a teplota, z - počet stupňov voľnosti. Celkovú kinetickú energiu systému Ek možno získať vynásobením Ek1 počtom častíc N v systéme:
Ek=NEk1=z/2NkBT.
Tak sme získali vzorec pre vnútornú energiu ideálneho plynu, zapísaný vo všeobecnom tvare z hľadiska absolútnej teploty a počtu častíc v uzavretom systéme:
U=z/2NkBT.
Monatomický a polyatomický plyn
Vzorec pre U napísaný v predchádzajúcom odseku článku je pre jeho praktické použitie nepohodlný, pretože je ťažké určiť počet častíc N. Ak však vezmeme do úvahy definíciu látkového množstva n, potom tento výraz možno prepísať do vhodnejšej podoby:
n=N/NA; R=NAkB=8,314 J/(molK);
U=z/2nR T.
Počet stupňov voľnosti z závisí od geometrie častíc, ktoré tvoria plyn. Pre jednoatómový plyn je teda z=3, pretože atóm sa môže nezávisle pohybovať iba v troch smeroch priestoru. Ak je plyn dvojatómový, potom z=5, pretože k trom translačným stupňom voľnosti sa pridajú ďalšie dva rotačné stupne voľnosti. Nakoniec pre akýkoľvek iný polyatómový plyn z=6 (3 translačné a 3 rotačné stupne voľnosti). S ohľadom na túto skutočnosť môžeme v nasledujúcej forme napísať vzorce pre vnútornú energiu ideálneho plynu monatomického, dvojatómového a polyatomického typu:
U1=3/2nRT;
U2=5/2nRT;
U≧3=3nRT.
Príklad úlohy na určenie vnútornej energie
100-litrový valec obsahuje čistý vodík pod tlakom 3 atmosféry. Za predpokladu, že vodík je za daných podmienok ideálny plyn, je potrebné určiť, aká je jeho vnútorná energia.

Vyššie uvedené vzorce pre U obsahujú množstvo látky a teplotu plynu. V stave problému sa o týchto množstvách nehovorí absolútne nič. Na vyriešenie problému je potrebné pripomenúť univerzálnu Clapeyronovu-Mendelejevovu rovnicu. Má vzhľad znázornený na obrázku.
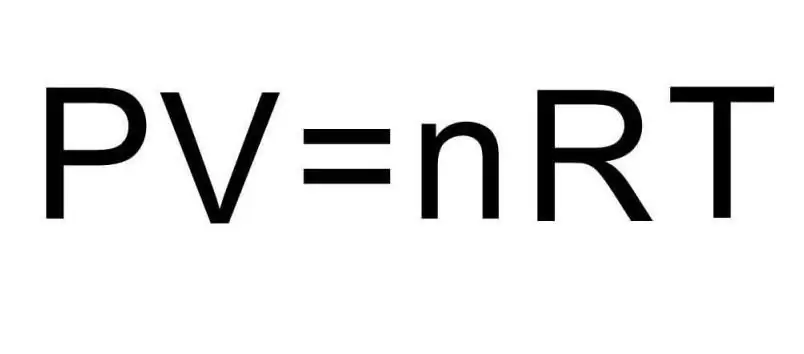
Keďže vodík H2 je dvojatómová molekula, vzorec pre vnútornú energiu je:
UH2=5/2nRT.
Porovnaním oboch výrazov dospejeme ku konečnému vzorcu na vyriešenie problému:
UH2=5/2PV.
Zostáva previesť jednotky tlaku a objemu z podmienky na sústavu jednotiek SI, dosadiť zodpovedajúce hodnoty vo vzorci za UH2 a získať odpoveď: UH2 ≈ 76 kJ.






