Adiabatický prechod medzi dvoma stavmi v plynoch nepatrí medzi izoprocesy, hrá však dôležitú úlohu nielen v rôznych technologických procesoch, ale aj v prírode. V tomto článku zvážime, čo je to za proces, a tiež uvedieme adiabatické rovnice pre ideálny plyn.
Ideálny plyn v skratke
Ideálny plyn je taký, v ktorom nedochádza k interakciám medzi jeho časticami a ich veľkosť je rovná nule. V prírode, samozrejme, neexistujú stopercentne ideálne plyny, keďže všetky sú zložené z molekúl a atómov o veľkosti, ktoré spolu vždy interagujú aspoň pomocou van der Waalsových síl. Napriek tomu sa opísaný model často vykonáva s dostatočnou presnosťou na riešenie praktických problémov pre mnohé skutočné plyny.
Hlavnou rovnicou ideálneho plynu je Clapeyronov-Mendelejevov zákon. Píše sa v nasledujúcom tvare:
PV=nRT.
Táto rovnica stanovuje priamu úmernosť medzi produktomtlak P na objem V a množstvo látky n na absolútnu teplotu T. Hodnota R je plynová konštanta, ktorá zohráva úlohu súčiniteľa úmernosti.
Čo je adiabatický proces?
Adiabatický proces je prechod medzi stavmi plynového systému, v ktorom nedochádza k výmene energie s prostredím. V tomto prípade sa menia všetky tri termodynamické charakteristiky systému (P, V, T) a množstvo látky n zostáva konštantné.
Rozlišujte medzi adiabatickou expanziou a kontrakciou. Oba procesy prebiehajú len vďaka vnútornej energii systému. Takže v dôsledku expanzie dramaticky klesá tlak a najmä teplota systému. Naopak, adiabatická kompresia má za následok pozitívny skok v teplote a tlaku.
Aby sa zabránilo výmene tepla medzi prostredím a systémom, systém musí mať tepelne izolované steny. Okrem toho skrátenie doby procesu výrazne znižuje tok tepla do a zo systému.
Poissonove rovnice pre adiabatický proces

Prvý termodynamický zákon je napísaný takto:
Q=ΔU + A.
Inými slovami, teplo Q odovzdané systému sa používa na vykonanie práce A systémom a na zvýšenie jeho vnútornej energie ΔU. Na napísanie adiabatickej rovnice by sa malo dať Q=0, čo zodpovedá definícii skúmaného procesu. Získame:
ΔU=-A.
S izochorickýmprocesu v ideálnom plyne, všetko teplo ide na zvýšenie vnútornej energie. Táto skutočnosť nám umožňuje zapísať rovnosť:
ΔU=CVΔT.
Kde CV je izochorická tepelná kapacita. Práca A sa zase vypočíta takto:
A=PdV.
Kde dV je malá zmena hlasitosti.
Okrem Clapeyronovej-Mendelejevovej rovnice platí pre ideálny plyn aj nasledujúca rovnica:
CP- CV=R.
Kde CP je izobarická tepelná kapacita, ktorá je vždy väčšia ako izochorická, pretože berie do úvahy straty plynu v dôsledku expanzie.
Analýzou rovníc napísaných vyššie a integráciou cez teplotu a objem sme dospeli k nasledujúcej adiabatickej rovnici:
TVγ-1=const.
Tu je γ adiabatický index. Rovná sa pomeru izobarickej tepelnej kapacity k izochorickej. Táto rovnosť sa nazýva Poissonova rovnica pre adiabatický proces. Použitím Clapeyronovho-Mendelejevovho zákona môžete napísať ďalšie dva podobné výrazy, iba prostredníctvom parametrov P-T a P-V:
TPγ/(γ-1)=const;
PVγ=const.
Adiabatický graf môže byť uvedený v rôznych osiach. Nižšie je zobrazený v osiach P-V.
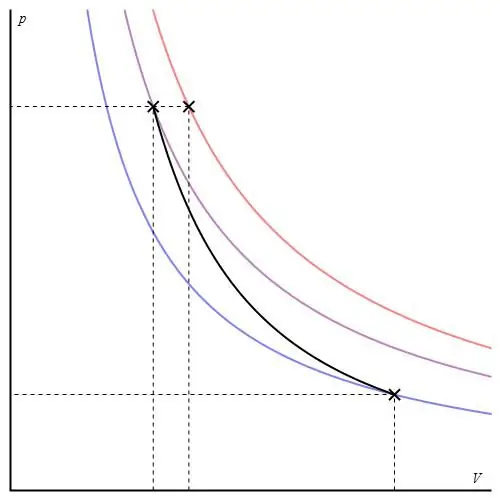
Farebné čiary na grafe zodpovedajú izotermám, čierna krivka je adiabat. Ako vidno, adiabat sa chová ostrejšie ako ktorákoľvek z izoterm. Táto skutočnosť sa dá ľahko vysvetliť: pre izotermu sa tlak mení späťúmerné objemu, ale pre izobatu sa tlak mení rýchlejšie, pretože exponent je γ>1 pre akýkoľvek plynový systém.
Príklad problému
V prírode, v horských oblastiach, keď sa vzduchová hmota pohybuje hore svahom, klesá jej tlak, zväčšuje svoj objem a ochladzuje sa. Tento adiabatický proces znižuje rosný bod a vytvára kvapalné a tuhé zrážky.

Navrhuje sa vyriešiť nasledujúci problém: v procese zdvíhania vzduchovej hmoty pozdĺž svahu hory klesol tlak o 30% v porovnaní s tlakom na úpätí. Aká bola jeho teplota, ak na nohách bola 25 oC?
Na vyriešenie problému použite nasledujúcu adiabatickú rovnicu:
TPγ/(γ-1)=const.
Je lepšie to napísať v tomto tvare:
T2/T1=(P2/P 1)(γ-1)/γ.
Ak sa P1 berie ako 1 atmosféra, potom P2 bude rovné 0,7 atmosféry. Pre vzduch je adiabatický index 1,4, pretože ho možno považovať za dvojatómový ideálny plyn. Hodnota teploty T1 je 298,15 K. Dosadením všetkých týchto čísel do vyššie uvedeného výrazu dostaneme T2=269,26 K, čo zodpovedá - 3, 9 oC.






